定期報告について
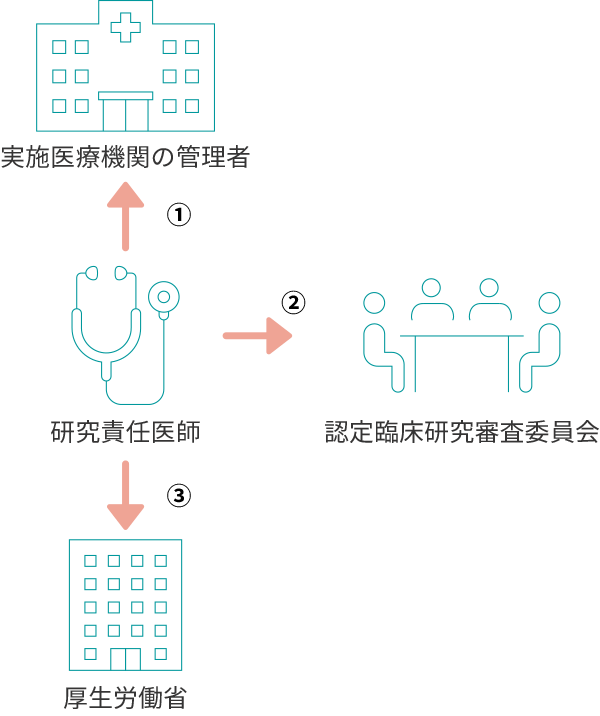
研究責任医師(多施設共同研究の場合は研究代表医師)は、特定臨床研究の実施状況について※1年ごとに、
①実施医療機関の管理者に報告した上で、
②認定臨床研究審査委員会へ報告することが定められています。
さらに認定臨床研究審査委員会が意見を述べた日から起算して1か月以内に
③厚生労働大臣への報告を行なうことが義務付けられています。
※横にスクロールして確認できます。
| 報告先 | 報告事項 | 報告時期 |
|---|---|---|
| 認定臨床研究審査委員会 |
臨床研究に参加した対象者の数 臨床研究に係る疾病等の発生状況及びその後の経過 省令又は研究計画書に対する不適合の発生状況及びその後の対応 臨床研究の安全性及び科学的妥当性についての評価 管理が必要な利益相反の関与に関する事項 |
実施計画を厚生労働大臣に提出した日(jRCT公表日)より、1年ごと、2か月以内に取りまとめて報告 例:公表日が2019年3月15日の場合、2019年3月15日~2020年3月14日の期間において実施状況を取りまとめ、2020年5月14日までに委員会へ報告を行う |
| 厚生労働大臣 |
実施計画に記載されている認定臨床研究審査委員会の名称 当該委員会による研究継続の適否 報告期間 臨床研究に参加した対象者の数 |
認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内 |
疾病等・不具合の報告について
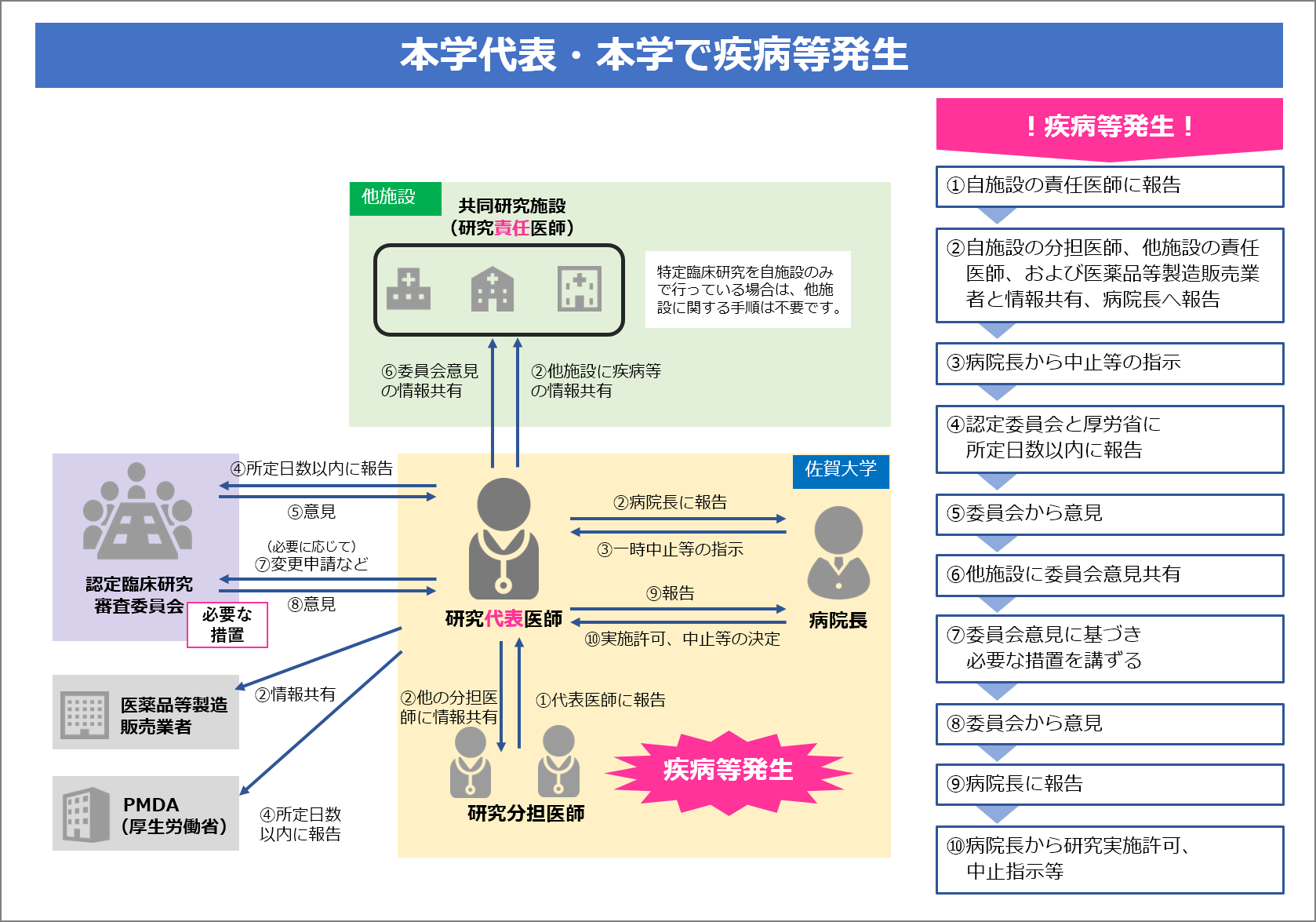
特定臨床研究の研究責任医師は、特定臨床研究の実施中に、下記の表に示す疾病等・不具合が発生した際に、実施医療機関の管理者および認定臨床研究審査委員会に報告することが臨床研究法により義務付けられています。
また、未承認・適応外の医薬品等の疾病等報告のうち、予期しない重篤なものについては、厚生労働大臣への報告も義務付けられており、jRCTのシステム内より行えます。
本学では、疾病等に該当しない重篤な有害事象(SAE)についても、実施医療機関の管理者および本学の認定臨床研究審査委員会に報告することが必要です。
※SAE報告の詳細は、こちら(Zipファイル)からダウンロードされる資料をご覧ください。
※当院の研究責任医師で判断に迷われる場合は、以下をご覧ください。
研究実施中の報告の流れ
報告期限一覧
既承認の医薬品等の疾病等報告
※横にスクロールして確認できます。
| PMDA | 委員会 | 定期報告 | |||
|---|---|---|---|---|---|
| 医薬品等 | 未知 | 死亡 | 15日 | ○ | |
| 重篤 | 15日 | ○ | |||
| 非重篤 | 定期 | ○ | |||
| 既知 | 死亡 | 15日 | ○ | ||
| 重篤 | 30日 | ○ | |||
| 非重篤 | 定期 | ○ | |||
| 感染症 | 未知 | 死亡・重篤 | 15日 | ○ | |
| 非重篤 | 15日 | ○ | |||
| 既知 | 死亡・重篤 | 15日 | ○ | ||
| 非重篤 | 定期 | ○ | |||
| 不具合 (医療機器、再生医療等製品) |
重篤(死亡含む)のおそれ | 30日 | |||
| 未知 | 非重篤のおそれ | ||||
| 既知 | 非重篤のおそれ | ||||
未承認・適応外の医薬品等の疾病等報告
※横にスクロールして確認できます。
| PMDA | 委員会 | 定期報告 | |||
|---|---|---|---|---|---|
| 医薬品等 | 未知 | 死亡・死亡のおそれ | 7日 | 7日 | ○ |
| 重篤 | 15日 | 15日 | ○ | ||
| 非重篤 | 定期 | ○ | |||
| 既知 | 死亡・死亡のおそれ | 15日 | ○ | ||
| 重篤 | 定期 | ○ | |||
| 非重篤 | 定期 | ○ | |||
| 不具合 (医療機器、再生医療等製品) |
未知 | 死亡のおそれ | 30日 | ||
| 重篤のおそれ | 30日 | ||||
| 非重篤のおそれ | |||||
| 既知 | 死亡のおそれ | 30日 | |||
| 重篤のおそれ | 30日 | ||||
| 非重篤のおそれ |
研究対象者に対する補償
研究責任医師は、臨床研究を実施するにあたって、あらかじめ当該臨床研究に伴い生じた健康被害の補償及び医療の提供のために保険へ加入し、医療を提供する体制の確保など、必要な措置を講じておかなければなりません。


