特定臨床研究実施の流れ(学外の方)
CRB:佐賀大学臨床研究審査委員会
特定臨床研究の開始時手続きに関するチェックリスト(厚労省HP掲載)につきましては、こちら(PDF)をご参照ください
STEP 1事前準備
CRBに必要な申請書類の準備
- 新規申請書式一括ダウンロード(Zip)
- 新規申請書類チェックリスト(本学CRB提出用)(PDF)
- 臨床研究法による臨床研究実施手順書(佐賀大学版 研究者用)第9.0版(PDF)
- 臨床研究法上の臨床研究における疾病等に該当しない重篤な有害事象発生時の手順書 第1.0版(PDF)
新規審査依頼書(統一書式2)
実施計画 ※実施計画(様式第一)記載例(厚生労働省HPより)(PDF)
研究計画書
同意説明文書、同意書、同意撤回書
医薬品等の概要を記載した書類
疾病等が発生した場合の手順書(研究計画書に記載することも可)
研究分担医師リスト(統一書式1)
保険加入に関する書類(加入前の場合は見積書等)
研究の適正実施に必要な教育研修を受けていることを証明できる書類(修了証等)(研究分担医師全て含む)
統計解析計画書(研究計画書に記載することも可)
実施医療機関の要件確認書(佐大書式4)
研究責任医師の略歴書(佐大書式5)
【以下必要があれば準備】※詳しくは手順書をご確認ください。
オプトアウト文書
監査手順書
研究補償保険加入手続き準備(研究補償保険見積依頼)
研究計画に関わる企業等との契約
利益相反関係書類の準備
| 単施設の場合 |
1.研究責任医師が利益相反管理基準(様式A)及び関係企業等報告書(様式B)を作成 2.研究責任医師と研究分担医師等が様式A・様式Bをもとに、研究者利益相反自己申告書(様式C)を作成 3.実施医療機関のCOI担当へ様式Cを提出し、事実確認を依頼 4.実施医療機関のCOI担当が作成した利益相反状況確認報告書(様式D)を受領 5.研究責任医師が全員分の様式Dをもとに、利益相反管理計画(様式E)を作成 6.研究責任医師は様式A・様式Eを審査資料として委員会へ提出 |
|---|---|
| 多施設の場合 |
1.研究代表医師が利益相反管理基準(様式A)及び関係企業等報告書(様式B)を作成 2.各施設の研究責任医師に利益相反管理計画(様式E)の作成を依頼 3.~各施設での手順は単施設の場合を参照~ 4.各施設の研究責任医師は作成した様式Eを研究代表医師へ提出 5.研究代表医師は様式Aと全施設分の様式Eを審査資料として委員会へ提出 多施設共同研究の場合は、研究代表医師の指示に従って書類を作成してください。 |
STEP 2書類提出
CRB申請窓口に書類を提出
書類提出先:crb@mail.admin.saga-u.ac.jp 提出期限:CRB開催の2ヶ月前
審査委受託契約 (佐賀大学医学部 臨床研究センター)
臨床研究センターにて申請書類の不備を確認
STEP 3CRB審査
本審査(毎月第2水曜日開催)
申請(書類提出)から審査のフロー
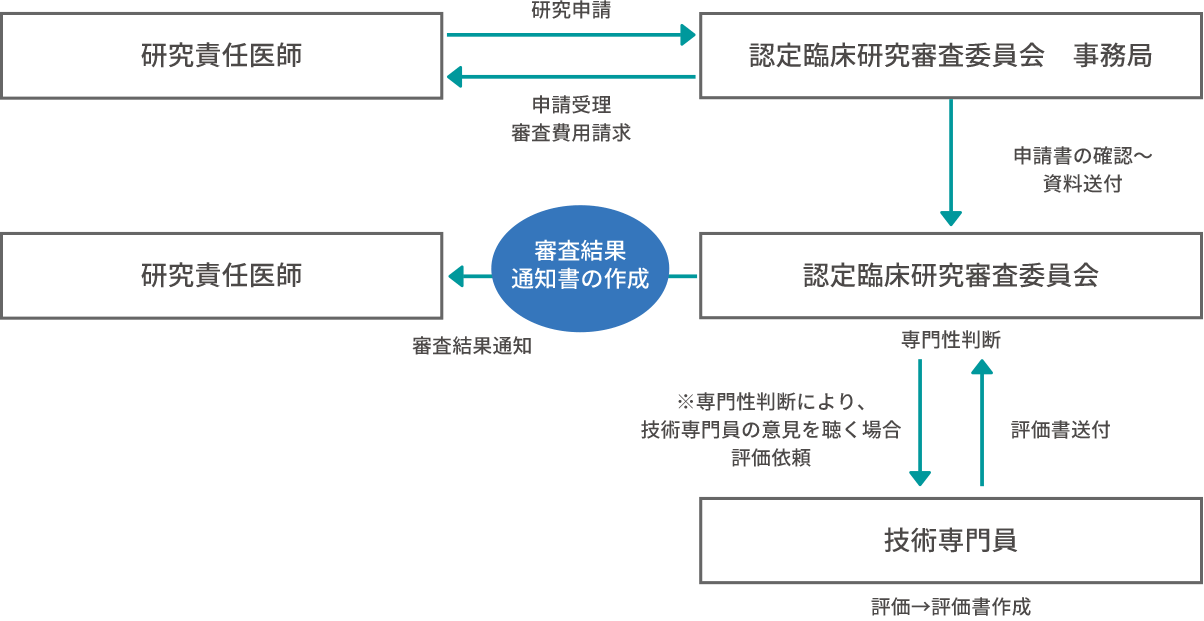
STEP 4厚生労働大臣への実施計画の届け出
審査終了後のフロー



STEP 5特定臨床研究開始
jRCTに実施計画のデータベースを公開し、研究開始
| 実施計画提出の報告 |
厚生労働大臣へ実施計画を提出し、jRCT公表後に報告。 実施医療機関の管理者へ報告 ★実施計画提出報告書 |
|---|---|
| 計画変更 |
CRBへの意見具申 ★変更審査依頼書 ★新旧対照表 ★変更を行った書類 ★実施計画事項変更届書 |
| 計画変更(軽微なもの) |
変更後10日以内にCRBへ通知、厚生労働大臣へ届出 ★軽微変更通知書 ★変更を行った書類 ★実施計画事項軽微変更届書 |
| 疾病等・不具合報告 重篤な有害事象(SAE)報告 |
実施医療機関の管理者へ報告 ★医薬品の疾病等報告書 ★医療機器の疾病等又は不具合報告書 ★再生医療等製品の疾病等又は不具合報告書 ★詳細記載用書式 (必要時には厚生労働大臣への報告) ★疾病等報告書(医薬品) ★疾病等報告書(医療機器) |
|---|---|
| 不適合報告 重大な不適合報告 |
実施医療機関の管理者へ報告(定期報告にてCRBへ報告) ★不適合報告書 重大な不適合の場合、実施医療機関の管理者へ報告 ★重大な不適合報告書 |
| モニタリング・監査 |
(定期報告にてCRBへ報告) ★モニタリング報告書 ★監査報告書 ※実施した場合は、定期報告の際に報告書を提出 |
|---|---|
| 定期報告 |
定期報告(1回/年)は、実施計画を厚生労働大臣へ提出した日(jRCT公表日)より、1年毎に実施状況を取りまとめ、2か月以内にCRBへ報告。 その後1か月以内に厚生労働大臣へ報告。 実施医療機関の管理者へ報告 ★定期報告書(CRB用) ★定期報告書(厚生労働大臣用) ★教育・研修に関する証明書(修了証等) ★利益相反管理基準 COI様式A ★利益相反管理計画 COI様式E ★モニタリング(監査)報告書 ※実施した場合 |
★は提出書類です。詳細な手順については、以下をご参照ください。
臨床研究法上の臨床研究における疾病等に該当しない重篤な有害事象発生時の手順書
STEP 6特定臨床研究終了
| 主要評価項目報告 |
主要評価項目報告書のデータベース記録・公表 ※主要評価項目に係るデータ収集終了から1年以内に作成し、その後遅滞なく実施医療機関の管理者へ提出。 ★変更審査依頼書 ★実施計画事項変更届書 ★主要評価項目報告書 |
|---|---|
| 中止報告 |
研究計画書の中止基準に従い中止した日から、10日以内にCRBへ通知、厚生労働大臣へ届出 ※中止届を提出した場合でも、臨床研究終了までの間、疾病等報告、定期報告等を行うこと。 ★実施計画 ★研究計画書 ★中止通知書 ★特定臨床研究中止届書 |
| 終了報告 |
総括報告書概要のデータベース記録・公表 ※全ての評価項目に係るデータ収集終了から1年以内に作成し、その後遅滞なく実施医療機関の管理者へ提出。 ★終了通知書 ★終了届書 ★統計解析計画書(ある場合) ★研究計画書 ★総括報告書及びその概要 |
※研究代表医師は、研究「終了」後5年間、記録を保存する義務有り


